{{cell.content}}





撰文 | 英成
#肿瘤#增殖和持续营养供应密不可分,这些营养需求部分依赖其所在微环境的代谢重编程获得 [1]。但在肿瘤微环境之外,癌细胞如何通过神经、血液等调控网络远距离调控其他器官仍不明确 [2]。肝脏作为维持体内稳态的中心代谢器官 [3],在碳水、蛋白质、氨基酸、脂质代谢中发挥重要作用。有趣的是,部分研究证据提示乳腺癌可改变肝脏尿素代谢 [4],进一步支持肿瘤和肝脏之间可能存在远距离的交叉互作。
近日,来自魏茨曼科学研究所的Ayelet Erez教授团队在Cancer Discovery上发表题为Early infiltration of innate immune cells to the liver depletes HNF4α and promotes extra-hepatic carcinogenesis的研究论文,报道了早期肿瘤可促肝脏髓系细胞浸润以下调代谢调控分子HNF4α而重编程肝脏代谢,而肝功能指标或与胰腺癌/乳腺癌等多癌种的临床结局紧密相关。

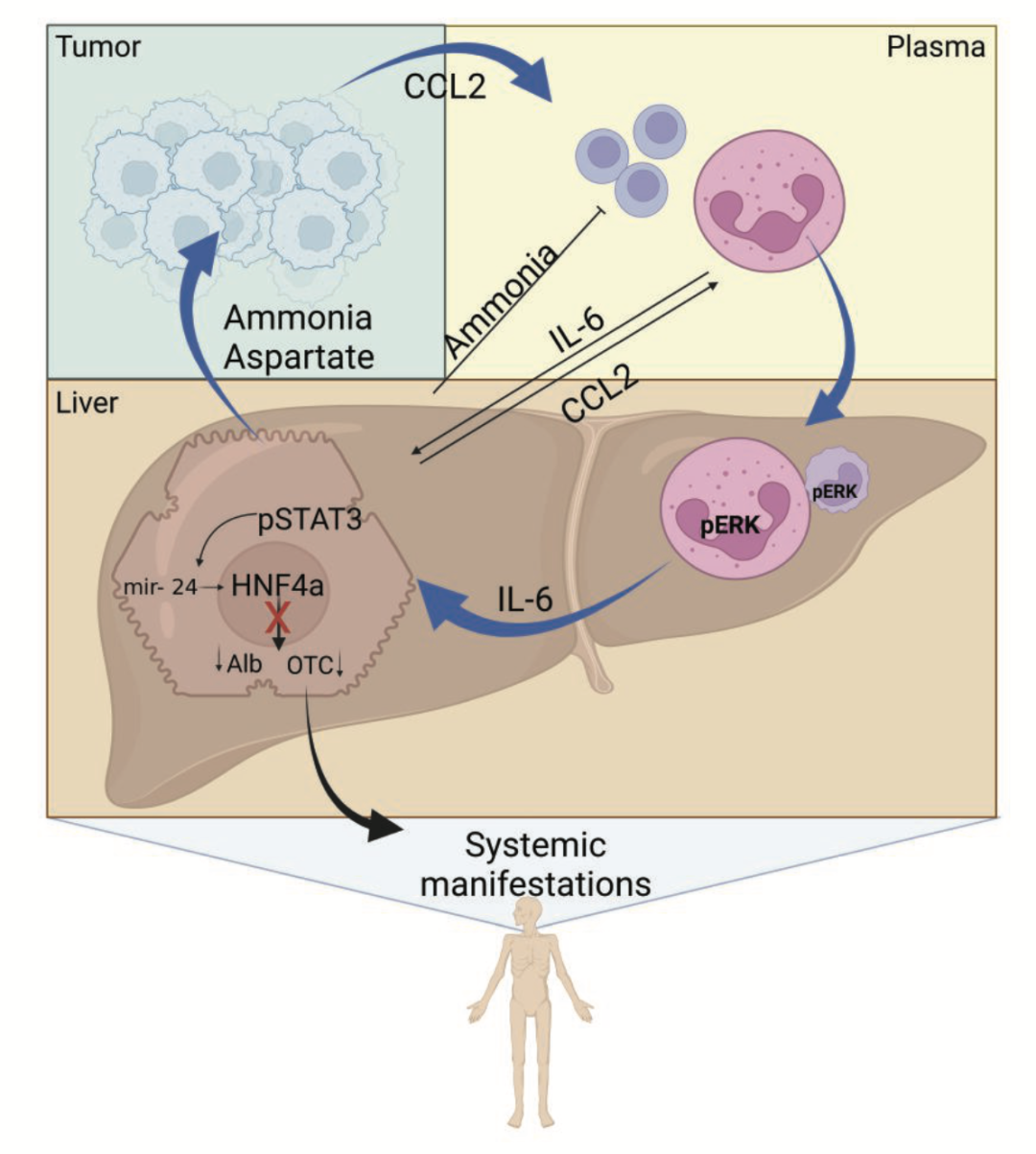
在这项研究中,研究人员利用小鼠乳腺癌模型探索了肝代谢酶和荷瘤时间之间的时间梯度关系。结果显示,肝脏特异的尿素循环相关酶均呈下降趋势,同位素标记的谷氨酰胺追踪、RNA-seq等也提示尿素循环代谢异常。研究人员进一步评估了肝脏免疫微环境和癌瘤发展时间的相关性,发现在癌细胞注射第4天起,肝脏可出现中性粒细胞浸润,并进一步分泌趋化因子CCL2。为了探索这种现象的潜在机制,研究人员发现髓系细胞的pERK激活可导致肝细胞代谢酶HNF4α下降,进一步的CCR2敲除模型和HNF4α回复模型验证了这一发现。
研究人员进一步利用胰腺癌模型验证了类似于乳腺癌模型的结果:注射胰腺癌细胞后1周内肝脏尿素循环即发生改变,成瘤3周前小鼠的肝脏逐渐出现髓系细胞浸润。这些数据进一步提示肿瘤和肝脏之间可能存在普遍性的远距离代谢互作。研究人员最后在乳腺癌和胰腺癌患者的临床队列中探索了肝功能指标和预后结局的关联,发现肝功能异常的患者预后显著更差。基于肝脏功能指标(AST、ALT、白蛋白等),研究人员开发了一个“肝脏评分”系统,可用于评估胰腺癌患者的临床结局。这一发现仍需要后续更高级别的循证医学数据来证实。
综上,该研究提示肿瘤可能通过远距离“劫持”肝脏代谢来促进其生长和扩散,同时也揭示了肝功能对于非肝脏系统肿瘤的潜在临床意义。除了肿瘤微环境之外,“肿瘤宏环境”对于优化癌症的诊断和治疗也至关重要,这一领域值得进一步的研究探索和广泛挖掘。
原文链接:https://doi.org/10.1158/2159-8290.CD-22-1062
参考文献
[1] Bader JE, Voss K, Rathmell JC. Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy. Mol Cell. 2020;78(6):1019-1033. doi:10.1016/j.molcel.2020.05.034
[2] Al-Zoughbi W, Hoefler G. Tumor Macroenvironment: An Update. Pathobiology. 2020;87(2):58-60. doi:10.1159/000502097
[3] Jensen-Cody SO, Potthoff MJ. Hepatokines and metabolism: Deciphering communication from the liver. Mol Metab. 2021;44:101138. doi:10.1016/j.molmet.2020.101138
[4] Lee JS, Adler L, Karathia H, et al. Urea Cycle Dysregulation Generates Clinically Relevant Genomic and Biochemical Signatures. Cell. 2018;174(6):1559-1570.e22. doi:10.1016/j.cell.2018.07.019


想了解更多精彩内容,快来关注BioArt生物艺术
特别声明:本文为人民日报新媒体平台“人民号”作者上传并发布,仅代表作者观点。人民日报提供信息发布平台。

写下你的评论
{{cell.content}}
{{item.content}}
{{item.content}}