{{cell.content}}





#肿瘤#的发生和发展离不开肿瘤细胞与微环境的互作。免疫抑制是肿瘤微环境的重要特征性改变,研究发现肿瘤细胞可通过多种方式抑制抗肿瘤免疫,实现免疫逃逸。PD-1/PD-L1是重要的免疫检查点分子,其在维持机体外周免疫耐受中发挥重要作用。PD-L1在多种肿瘤中高表达,肿瘤细胞表面的PD-L1可与T细胞表面的PD-1结合,向T细胞传递抑制性信号,使肿瘤细胞免于T细胞介导的杀伤作用。目前,以PD-1/PD-L1抑制性抗体为代表的免疫检查点阻断(Immune checkpoint blockade, ICB)已广泛用于多种晚期实体瘤的临床治疗,并因其良好而持久的疗效而备受关注。然而,在未经选择的实体瘤患者中,仅有10-30%的患者获益。如何提高ICB疗效是目前亟待解决的临床难题,而对肿瘤细胞PD-L1表达调控机制的深入研究有望为提高PD-1/PD-L1疗效提供新线索,为靶向抑制PD-1/PD-L1信号提供新途径。
随着人类基因组计划的完成和测序技术的发展,长链非编码RNA(lncRNA)已经成为全面理解多种生理和病理过程不可或缺的重要组分。大量研究表明,lncRNA即可参与调控机体免疫细胞的分化和活性,也可影响肿瘤的发生和发展;而肿瘤细胞自身表达的lncRNA分子参与调控T细胞免疫的研究却相对滞后。
2023年4月4日,哈尔滨工业大学生命科学与技术学院胡颖教授课题组在The Journal of Clinical Investigation杂志发表了题为Long noncoding RNA HITT coordinates with RGS2 to inhibit PD-L1 translation in T cell immunity的研究论文。该研究深入解析了肿瘤细胞自身表达的lncRNA分子参与调控PD-L1蛋白翻译的新机制,并发现了该机制在调控T细胞抗肿瘤免疫中的重要作用。

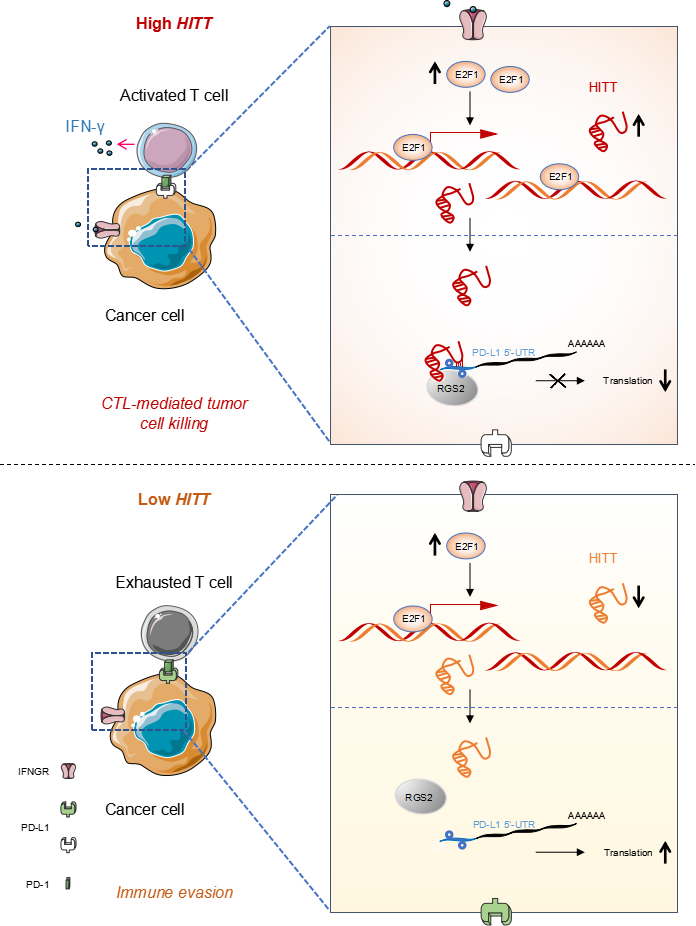
该团队通过分析多种肿瘤细胞高频缺失的染色体位点,鉴定出了一个具有潜在抑癌活性的lncRNA基因,并将其命名为 HITT(HIF-1α inhibitor at translation level)。前期研究发现HITT可对低氧,DNA损伤等应激因素作出应答,HITT低表达的肿瘤细胞表现为应激压力下的生存优势。该团队最新数据则显示HITT基因可被INFr信号转录激活,进而提高T细胞介导的肿瘤细胞杀伤效应。
TCGA数据分析发现HITT在包括乳腺癌在内的多种肿瘤组织中低表达,并与患者不良预后相关。为明确其主要作用机制,研究人员对具有不同HITT表达水平的肿瘤细胞进行了蛋白质组学检测和分析,结果发现差异表达蛋白主要富集到了T细胞免疫相关通路。乳腺癌原位移植瘤模型的研究表明,HITT可明显抑制移植瘤在BALB/c小鼠体内的生长。CD8抗体抑制CD8+T细胞活性后,HITT的抑瘤效应大大降低。上述数据提示HITT可能通过CD8+ T细胞发挥抑瘤功能。研究人员还发现,HITT相关表达差异蛋白中PD-L1是变化最为显著T细胞免疫相关靶点。随后的T细胞杀伤实验表明,HITT的确可通过抑制PD-1/PD-L1信号促进T细胞免疫。进一步的分子机制研究显示,HITT可与RGS2蛋白以及PD-L1-5ʹUTR形成三元复合物,进而抑制PD-L1-5ʹUTR依赖的PD-L1 mRNA的翻译和蛋白合成。由于HITT在乳腺癌细胞内低表达,抑制PD-L1蛋白翻译的能力降低,导致PD-L1表达升高。提高乳腺癌细胞内HITT的表达水平可有效增强PD-1抗体对乳腺癌原位移植瘤的免疫治疗效果,延长小鼠的生存周期,提高小鼠的存活率。乳腺癌瘤内注射表达HITT的慢病毒颗粒表现出与PD-1抗体相似的治疗效果,二者联用则表现出协同抑瘤效应。
综上所述,该项研究发现了表达于肿瘤细胞,具备调控T细胞免疫能力的lncRNA基因HITT,揭示了HITT调控PD-L1蛋白翻译和表达的分子机制,明确了HITT在靶向PD-1/PD-L1信号,提高免疫检查点阻断疗效中的作用,提示HITT分子作为免疫检查点阻断因子的潜在临床应用价值。
哈尔滨工业大学生命科学与技术学院胡颖为通讯作者,其团队博士研究生林庆宇为第一作者,哈尔滨医科大学肿瘤医院刘通医生为共同第一作者。
原文链接:
https://doi.org/10.1172/JCI162951


想了解更多精彩内容,快来关注BioArt生物艺术
特别声明:本文为人民日报新媒体平台“人民号”作者上传并发布,仅代表作者观点。人民日报提供信息发布平台。

写下你的评论
{{cell.content}}
{{item.content}}
{{item.content}}