{{cell.content}}





近期,欧洲海事安全局(EMSA)发布了“氨作为航运燃料的潜力”(POTENTIAL OF AMMONIA AS FUEL IN SHIPPING)的报告。本栏目将陆续刊发报告的详细内容,以期为航运脱碳带来更多有价值的参考。
1.1.2 技术对策
目前,氨(灰氨)生产所需的氢一般是通过对天然气进行蒸汽甲烷重整(SMR)或自热转化(ATR)获取(Yusef Bicer,2017)。如果天然气转化过程中排放的二氧化碳能够被捕获和储存,那么生产的氨通常称为“蓝氨”。然而,甲烷(一种比二氧化碳威力更强的温室气体,根据联合国政府间气候变化专门委员会第六次评估报告(IPCC AR6),以20年为单位甲烷造成全球暖化的威力是二氧化碳的82.5倍,以100年为单位是29.8倍)可能会在生产工厂或分销链的任意一个环节发生泄漏。另外,SMR和ATR的二氧化碳捕获率低于95%。
此外,蓝氨生产依然需要依赖化石燃料。因此,由可再生能源制成的氢(绿氢)生产的 “绿氨”,通常被认为是氨的生产和使用实现去碳化的最终解决方案;蓝氨则起到过渡作用。
1.1.3 生产路径
如图1所示,绿氨主要有五条生产路径,大多都是从生产可再生氢开始。前3条路径(1至3)将可再生氢生产技术与哈伯-博施合成工艺相结合;路径4将可再生氢技术与创新性合成工艺(非热等离子体合成)相结合;而路径5(电化学合成氨)不需要分离氢生产步骤。
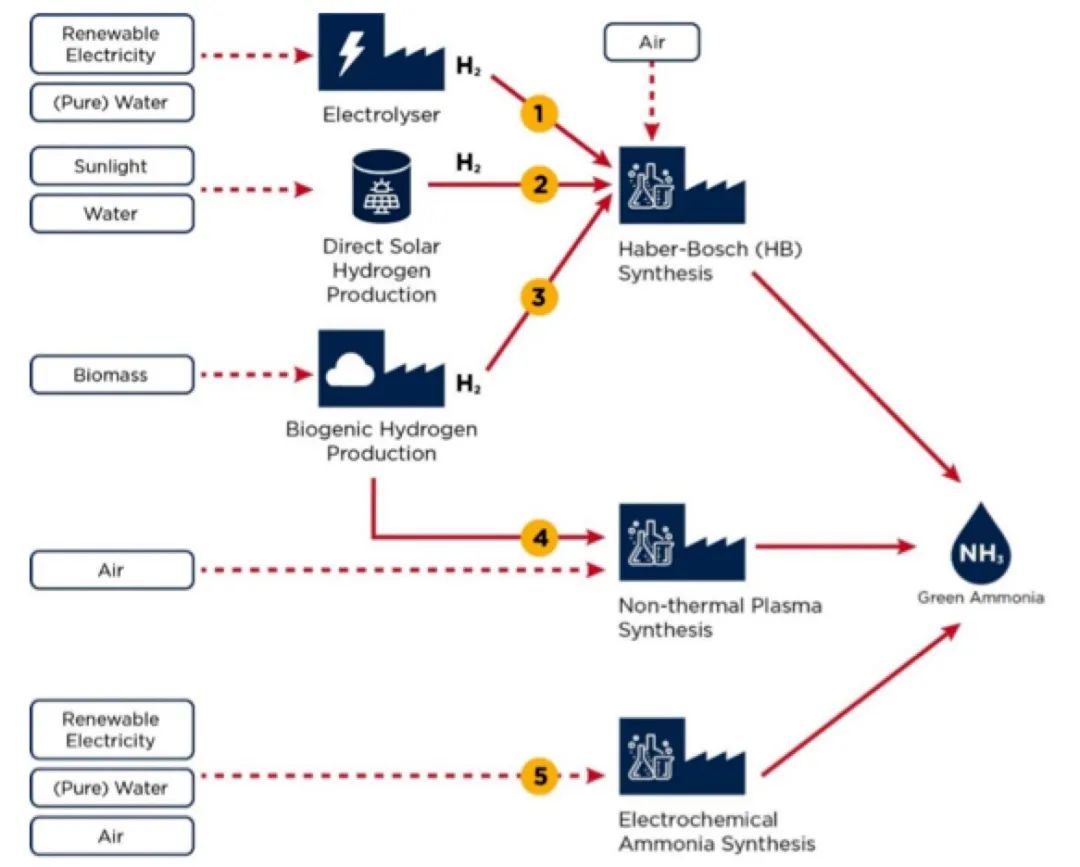
图1 绿氨生产路径
(注:空气用于生产氨合成工艺所需的氮气)
✍路径1:电解和哈伯-博施合成工艺
几十年来,用氨(灰氨)生产化肥的主要工艺是将化石燃料转化为氢,并利用低温空气分离、变压吸附或膜渗透法从大气中提取氮气(Rouwenhorst等人,2019)。
然后,利用哈伯-博施氨合成工艺将氢和氮气转化为氨(灰氨)。
“绿氨”生产的主要路径是利用可再生能源电力进行水电解生成绿氢,然后将绿氢用于哈伯-博施合成工艺(如图2所示)。
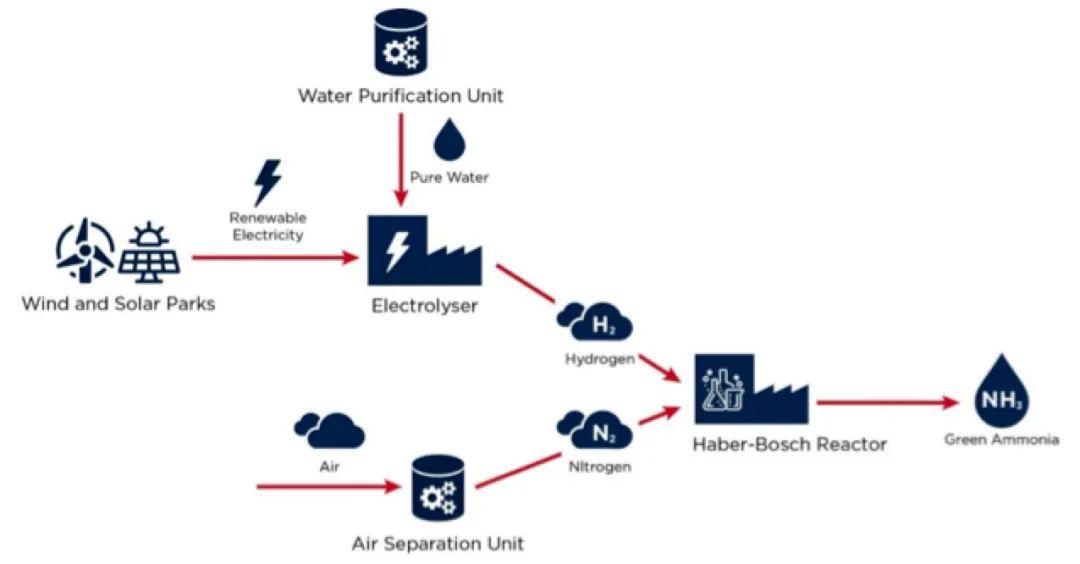
目前,有一些生产工厂部分使用绿氢。其实,在氨生产中使用绿氢并不新鲜。直到20世纪60年代,在欧洲销售的大多数化肥的生产都是利用基于水力发电的电解法和挪威的氨生产。
哈伯-博施合成是一个放热过程,使用高操作温度(400-500℃)和压力(150-300bar)。在这个过程中,氮气和氢直接结合。同时,因为有金属催化剂的存在,合成过程加速进行。
固定床反应器和流化床反应器是两种主要的合成反应器,技术均已成熟。不过,尽管哈伯-博施法是一项成熟的技术,但仍有改进的空间。例如,通过改进催化剂可以提高产量。
电解器技术有几个可选项。碱性技术是目前最先进和最经济的选择。聚合物电解质膜(PEM)电解器的开发程度较低,价格较高,但预计在操作层面比碱性电解器更灵活。
固体氧化物电解池(SOEC)技术还未实现商业化,因此距离大规模实施还有一段时间。该技术在高温下工作,并有可能提供最高的能源效率,特别是在与氨合成或聚光太阳能工厂结合时,能够实现热利用(IEA, 2017)。不同类型的电解器技术如图3所示。
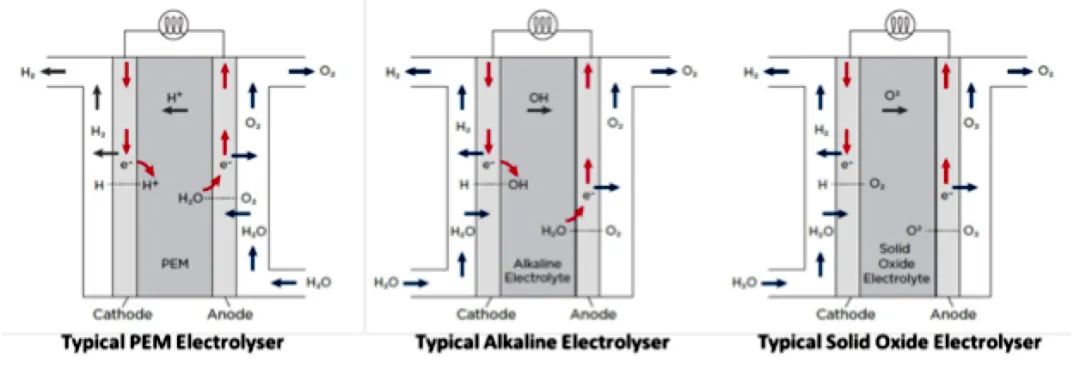
此外,PEM电解器使用质子交换膜,即固体聚合物电解质(也被称为聚合物电解质膜电解器)。当通电时,水分裂成氢和氧,氢质子穿过质子交换膜,在阴极一侧形成氢气。
增加的电流密度使系统对能量输入的波动作出更快速的反应,这在使用间歇性可再生能源时益处很大。PEM电解器在50℃至80℃之间的温度下运行,但压力比碱性电解器高。
具有代表性的PEM电解器制备使用的稀土金属比碱性电解器更多,并且需要更精细的催化剂制备工艺,这使得其在生产和维护层面更加昂贵。
碱性电解器使用液体电解质,如氢氧化钾(KOH)或氢氧化钠(NAOH),以及水。当通电时,氢氧根离子(OH-)穿过电解质从电池的阴极移动到阳极,在电解器的阴极一侧产生氢气泡,在阳极产生氧气(如图3所示)。
这些电解器设计可以是单极的,也可以是复极的。单极设计,也被称为箱式设计,其电极平行地悬浮在并列的小室中,由薄膜隔开,隔膜允许离子转移,但限制所产生气体的移动。复极设计阴阳两极的位置非常靠近,由一层非导电薄膜隔开。
单极设计的优点是更经济、容易制造和维护,但其效率通常比复极设计低。碱性电解器在接近其设计负荷时运行效果最好,在较低负荷下运行时效率会下降。与PEM和固体氧化物电解器相比,碱性电解器单、复极设计都更耐用,并且昂贵稀土金属的含量更少。
固体氧化物电解器使用固体陶瓷材料作为电解质。来自外部电路的电子与阴极处的水结合,形成氢气和带负电的离子。接下来,氧离子穿过固体陶瓷膜,在阳极反应形成氧气,并为外部电路生成电子。固体氧化物电解器不太可能被使用,因为其通常需要在700℃以上的温度才能运行。
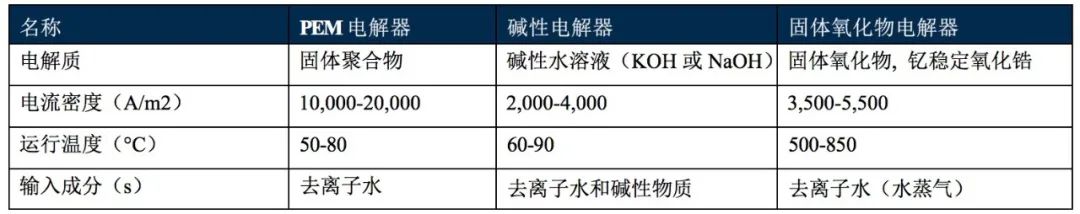
电解器需要纯净的去离子水来分裂成氢气和氧气。为了生产这种水,可以使用过滤、去离子和/或反渗透工艺对淡水进行净化。如果获得淡水有困难,可以对海水进行脱盐和净化。不同类型的电解器比较如表2所示。
表2 不同类型的电解器比较
为了将灰氨工厂转变为绿氨工厂,可以用电解器取代SMR装置,从而使氨生产的二氧化碳排放量减少78%(注意,这取决于电力行业的二氧化碳排放强度)。此外,使用当前的电解技术将导致氢生产过程中的能量损失较大,但氨合成过程中的能量损失较小。
最终结论是,与使用蒸汽甲烷转化天然气生产灰氨相比,生产绿氨需要更多的能量,但这些能量是可再生的。与生产灰氨的总能耗相比,SOEC技术有可能减少生产绿氨的总能耗(Smith等人, 2020)。
只有在电解过程中使用的电力是可再生的情况下,由绿氢制成的氨才被视为“绿氨”。这将需要直接使用由风力涡轮机或太阳能板等生产的电力,或购买可再生能源电力证书后被视为“绿电”的电网电力。
可信赖的可再生电力证书交易市场也需要到位。这将使电解器能够应用到其他地方,比如有可能在能源系统层面提供成本效益,但消除了在合成过程中使用其余热的机会。
路径1的可再生能源电力输入约为燃料低热值的1.85倍,换句话说,路径1的效率约为54%(Ghavam等人,2021)。然而,根据Rouwenhorst等人(2020)对绿氨生产方法的比较分析,等待技术进一步发展之后,能源效率(LHV)有可能达到72%。
✍路径2:太阳能直接制氢
生产可再生氢的另一种方式是通过“太阳能直接制氢”(也称为光电化学制氢),这是一种不使用电解装置直接从水中生产氢的工艺。这项技术利用光电化学电池,可以驱动水裂解氧化还原反应。太阳能制氢过程中,使用聚光太阳能热发电(使用反射镜或透镜汇聚阳光)(IEA,2017)、光伏(PV)电池(Bellini,2021)或光敏材料(Radowitz,2021)产生电能。目前,该技术正处于研究和开发阶段,在太阳辐射角系数高和天气晴朗的地区,将有最高的氢产量。
由于此工艺仍处于早期开发阶段,因此很难给出其能源效率的可靠数字。在Rouwenhorst等人(2020)的分析中,提出生产1kg氨可能需要200MJ能量,即能源效率(LHV)为9%。这一数值较低的原因,可能是太阳辐射转化为能源的效率较低,也就使得很难将生产路径2与其他路径进行比较。然而,考虑到该技术的“发展中”性质,持续评估其效率和就绪情况是很重要的,因为其效率可能会发展到70%(Rouwenhorst, 2022)。
✍路径3:生物制氢
生产可再生氢的第3种方法是分解生物质中的碳氢化合物分子。这种方法可通过不同的技术过程实现。暗发酵是一个厌氧过程(缺乏或不存在氧),在此过程中使用细菌将生物质分解为氢、二氧化碳和其他副产物。
可使用的细菌类型非常广泛,它们可能在不同的温度范围内活跃。在25℃至70℃之间活跃的厌氧菌可用于转化生物质化合物,如蔗糖、纤维素、葡萄糖和淀粉。暗发酵技术仍处于早期开发阶段,主要问题是所生产氢气的浓度较低(40%-60%)。
一个研究领域着眼于通过将暗发酵工艺与其他工艺和技术,如光发酵、产甲烷、微生物电解池和微生物燃料电池耦合来提高氢产量(Ghavam等,2021)。
通过生物质热气化技术,木质生物质能够被分解成氢、一氧化碳和二氧化碳,然后可以用膜分离等方法将氢从气体混合物中分离出来。
通过超临界水气化技术,高湿生物质原料,如有机废弃物和污水污泥可以被 “气化”,形成氢和甲烷。其中甲烷可以在接下来的重整步骤中转化为氢。
热气化已经投入商用,但规模不大。超临界水气化还没有经过市场检验。
路径3仍然处于早期开发阶段,同样很难给出能源效率的可靠数字。在Rouwenhorst等人(2020)的分析中,提出生产1kg氨的潜在能源需求为33MJ,即能源效率(LHV)为57%。
✍路径4:非热等离子体合成
哈伯-博施法的替代方法是非热等离子体合成。这种合成工艺也处于研究和开发阶段,在低温(约50℃)和低压(约1bar)下运行,不使用化石燃料,资金成本低,适用于小规模氨生产。
然而,开发这项技术面临3个方面挑战:氮的固定、逆反应和提高转换和能源效率。弗吉尼亚大学研究公司开发的一项等离子体技术可以通过等离子体激发的方式将可再生能源电力、水和空气转化为氨。这一技术利用微波等离子体工艺激活氮和氢,产生离子和自由基,催化反应后形成氨。该工艺也可以在低温和低压下进行,并且操作灵活(Ghavam等人,2021)。
路径4同样处于早期开发阶段,很难给出关于其能源效率的可靠数字。在Rouwenhorst等人(2020)的分析中,提出生产1kg氨需要50MJ-150MJ能量,即能源效率(LHV)为12%至37%。随着技术的发展,有可能将这一效率提高到40%-45%(Rouwenhorst, 2022)。
✍路径5:电化学合成氨
电化学合成氨是一种不需要分离工艺的绿氨生产路径。这项技术仍处于研究和开发阶段,利用电化学电池从氮气、水和电力中生产氨。
将电压施加到电池的电极上,释放出的离子通过分离膜和电解质到达带相反电荷的电极。化学反应产生,水被分解成氧气和氢气,氢气与氮气反应形成氨;或者氢离子(H+)被转移到氮气中形成氨,而无需先形成氢分子(H2)。
可用于电化学合成氨的电解质主要有四种:液体电解质(在室温条件下操作);熔盐电解质(180℃-500℃);复合膜电解质(300℃-700℃);固体电解质(10℃-800℃,取决于膜的类型)。复合膜电解质由固体和低熔盐电解质混合组成。
与哈伯-博施法相比,电化学合成氨有以下优势:能源效率较高;选择率较高(减少了净化需求);温度和压力较低;以及模块化。不过,电化学合成法也存在氨生产率低和膜不稳定的问题(Ghavam等人, 2021)。
与电解器和哈伯-博施合成的组合(路径1)相比,固体氨合成(SSAS),即使用固体电解质的电化学合成,有望降低能源使用量。每吨氨的能耗从7,000-8,000kWh降低到12,000kWh,也就是减少33%-42%(Bartels和Pate, 2008)。
熔盐电解质有可能减少30%的电力消耗,但避免形成氢是必须克服的技术挑战(IEA, 2017)。电化学合成的普遍难题是开发催化剂,以提高该工艺的性能(即产氨率)。
路径5仍处于早期开发阶段,很难给出关于其能源效率的可靠数字。在Rouwenhorst等人(2020)的分析中,提出生产1kg氨需要30MJ-135MJ能量,即能源效率(LHV)为14%至62%。较大的变化幅度反映出该技术处于早期开发阶段,以及未来能源效率的不确定性,因此很难根据能源效率对这些路径进行排名。原则上来说,路径5的能源效率可以达到90%,但在达到这个阶段之前,还需要进一步的技术发展(Rouwenhorst,2022)。


特别声明:本文为人民日报新媒体平台“人民号”作者上传并发布,仅代表作者观点。人民日报提供信息发布平台。

写下你的评论
{{cell.content}}
{{item.content}}
{{item.content}}